3.1. Водно-электролитные расстройства.
Расстройства водного и электролитного обмена при ЧМТ представляют собой разнонаправленные изменения. Они возникают вследствие причин, которые можно разделить на три группы:
1.Нарушения, типичные для любой реанимационной ситуации (одинаковые при ЧМТ, перитоните, панкреатите, сепсисе, желудочно-кишечном кровотечении).
2.Нарушения, специфичные для поражений мозга.
3.Ятрогенные нарушения, вызванные вынужденным или ошибочным применением фармакологических и нефармакологических средств лечения.
Трудно найти еще одно патологическое состояние, при котором наблюдались бы столь разнообразные водно-электролитные нарушения, как при ЧМТ, и настолько была велика угроза для жизни при их несвоевременной диагностике и коррекции. Для понимания патогенеза этих расстройств остановимся подробнее на механизмах, регулирующих водно-электролитный обмен.
Немного физиологии
Три «кита», на которых держится регуляция водно-электролитного обмена – это антидиуретический гормон (АДГ), ренин-ангиотензин-альдостероновая система (РААС) и предсердный натрийуретический фактор (ПНФ) (рис. 3.1).
АДГ влияет на реабсорбцию (то есть на обратное всасывание) воды в почечных канальцах. При включении пусковых механизмов (гиповолемия, артериальная гипотензия и гипоосмоляльность) из задней доли гипофиза выбрасывается в кровь АДГ, что приводит к задержке воды и вазоконстрикции. Секрецию АДГ стимулируют тошнота и ангиотензин II, а тормозит - ПНФ. При избыточной выработке АДГ развивается синдром избыточной выработки антидиуретического гормона (СИВАДГ). Для реализации эффектов АДГ, кроме адекватного функционирования задней доли гипофиза, необходима нормальная чувствительность специфических АДГ-рецепторов, находящихся в почках. При снижении выработки АДГ в гипофизе развивается так называемый центральный несахарный диабет, при нарушении чувствительности рецепторов – нефрогенный несахарный диабет.
РААС влияет на выведение почками натрия. При включении пускового механизма (гиповолемии) наблюдается снижение кровотока в юкстамедуллярных клубочках, что приводит к выбросу в кровь ренина. Повышение уровня ренина вызывает превращение неактивного ангиотензина I в активный ангиотензин II. Ангиотензин II индуцирует вазоконстрикцию и стимулирует выброс надпочечниками минералокортикоида - альдостерона. Альдостерон вызывает задержку воды и натрия, в обмен на натрий обеспечивает выведение калия и кальция за счет обратимой блокады их канальцевой реабсорбции.
ПНФ в известной мере можно рассматривать как гормон-антагонист для АДГ и РААС. При увеличении объема циркулирующей крови (гиперволемии) повышается давление в предсердиях, что приводит к выбросу в кровь ПНФ и способствует выведению натрия почками. По современным данным, аналогично ПНФ действует уабаин, низкомолекулярное соединение, образующееся в гипоталамусе. Вероятнее всего, избыток уабаина ответственен за развитие церебрального сольтеряющего синдрома.
3.1.1. Механизмы нарушения регуляции водно-электролитного обмена при ЧМТ
Волемические нарушения наблюдаются при любой реанимационной ситуации. ЧМТ не является исключением из этого правила. Активация всех звеньев регуляции водно-электролитного обмена при повреждениях мозга происходит из-за развития гиповолемии. При ЧМТ включаются и специфичные для поражений мозга механизмы нарушения регуляции. Они запускаются при повреждении диэнцефальных областей мозга и нарушении связей гипоталамуса с гипофизом вследствие прямой травмы, нарастания дислокации мозга или сосудистых расстройств. Результатом активности данных специфических механизмов являются характерные для церебральной патологии изменения выработки АДГ, уабаина, тропных гормонов передней доли гипофиза (например, адренокортикотропного гормона, опосредованно влияющего на уровень альдостерона).
Гипертонические растворы, оптимизированная гипервентиляция, гипотермия, используемые для купирования внутричерепной гипертензии - это вынужденные ятрогенные меры, углубляющие водно-электролитные расстройства. Применение салуретиков при ЧМТ чаще всего (но не всегда!) представляет собой пример использования препаратов по ошибочным показаниям, что вызывает грубые нарушения водно-электролитного баланса.
Дисфункция гормонов, регулирующих водно-электролитный баланс, приводит к нарушениям волемического статуса (гипо- и гиперволемии), содержания натрия (гипо- и гипернатриемии), осмоляльности (гипо- и гиперосмоляльности). Отмечаются нарушения содержания калия, магния, кальция, кислотно-основного состояния. Все эти расстройства взаимосвязаны. Однако мы начнем с описания нарушений концентрации натрия, который является центральным ионом, регулирующим осмотическое давление крови и определяющим баланс воды между внутрисосудистым руслом и интерстициальным пространством мозга.
Нарушения содержания натрия
Нарушения содержания натрия бывают двух типов – гипернатриемия и гипонатриемия (табл. 5).
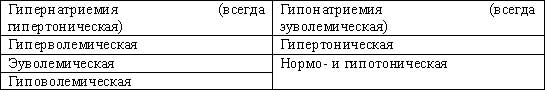 Табл.5. Типы нарушений содержания натрия
Табл.5. Типы нарушений содержания натрия
Гипернатриемия
Гипернатриемию, в зависимости наличия волемических расстройств, делят на гиповолемическую, эуволемическую и гиперволемическую. Гипернатриемия всегда сопровождается повышением эффективной осмоляльности крови, то есть является гипертонической.
Гиповолемическая гипернатриемия
Гиповолемическая гипернатриемия наиболее часто отмечается на начальных стадиях ЧМТ. Причины гиповолемической гипернатриемии на этом этапе – ренальные и эктраренальные потери жидкости, не компенсированные достаточным поступлением ее в организм. Нередко имеет место кровопотеря, а также сочетанные повреждения. Так как пострадавший находится в измененном сознании, он теряет возможность адекватно реагировать на водные потери через почки и кожу. Частым симптомом внутричерепной гипертензии является рвота. Поэтому потери жидкости через желудочно-кишечный тракт тоже могут играть существенную роль в развитии гиповолемии. Возможно также перемещение жидкости в так называемое третье пространство из-за секвестрации в паретичном кишечнике.
Результатом активации описанных механизмов является гиповолемия. Организм пытается компенсировать потерю внутрисосудистого объема за счет привлечения жидкости из интерстициального пространства. Это простанство обезвоживается, но привлекаемой жидкости не хватает для «заполнения» внутрисосудистого пространства. В результате возникает внеклеточная дегидратация. Так как теряется в основном вода, то уровень натрия во внеклеточном секторе (интерстициальном и внутрисосудистом пространстве) повышается.
Гиповолемия запускает еще один механизм гипернатриемии: развивается гиперальдостеронизм, что приводит к задержке в организме натрия (J.J. Marini, A.P. Wheeler, 1997). Эта реакция тоже приспособительная, так как осмотически активные свойства натрия позволяют задержать в организме воду и компенсировать гиповолемию. В то же время задержка натрия приводит к компенсаторному выведению калия, что сопровождается целым рядом негативных последствий.
Включение описанного патологического механизма возможно и в более поздние периоды ЧМТ, однако столь выраженной гиповолемии, как на ранних этапах, не отмечается, поскольку больной к этому моменту уже получает лечение.
Эуволемическая гипернатриемия
Этот тип гипернатриемии возникает при преобладании потерь воды над потерями натрия. Он наблюдается при дефиците или неэффективности АДГ, использовании диуретиков, синдроме переустановки осмостата.
Дефицит АДГ носит название безвкусного, бессолевого диабета, diabetes insipidus (так как моча содержит мало солей) и иначе центрального несахарного диабета. Центральный несахарный диабет возникает из-за прямого поражения гипофиза или нарушения его кровоснабжения. Синдром характеризуется нарушением выработки АДГ и сопровождается гипернатриемией из-за избыточного выделения гипотоничной мочи с низким содержанием натрия. Лечение синдрома сводится к применению синтетических заменителей антидиуретического гормона и коррекции водных потерь.
Неэффективность АДГ, иначе называемая нефрогенным несахарным диабетом, может развиваться при сопутствующих заболеваниях почек, гиперкальциемии, гипокалиемии. Хронический прием некоторых лекарственных средств (например, лития при депрессивных расстройствах) может снижать чувствительность почечных рецепторов к действию АДГ.
Петлевые диуретики, например фуросемид, обладают непредсказуемым эффектом на выведение натрия и воды. В некоторых ситуациях может теряться больше воды, чем натрия, в результате чего развивается гипернатриемия. Предполагается, что механизм этого явления связан с влиянием петлевого диуретика на чувствительность почечных АДГ-рецепторов, то есть фактически представляет собой вариант нефрогенного несахарного диабета. В других случаях теряется больше натрия, чем воды, и развивается гипонатриемия.
Синдром переустановки осмостата – своеобразное состояние, которое характеризуется установлением нового нормального уровня натрия крови и соответствующим изменением ее осмоляльности. По нашим данным, при ЧМТ синдром переустановки осмостата чаще приводит к появлению более низкой, а не более высокой нормы натрия, поэтому мы рассмотрим его подробнее в разделе, посвященном гипонатриемии.
Гиперволемическая гипернатриемия
Данная форма гипернатриемии при ЧМТ отмечается редко. Она всегда возникает ятрогенно. Основной причиной является введение избытка натрийсодержащих растворов - гипертонических (3-10%) растворов натрия хлорида, а также 4% раствора натрия бикарбоната. Второй причиной является экзогенное введение кортикостероидов, в той или иной степени обладающих минералокортикоидными свойствами. Из-за избытка альдостерона происходит задержка натрия и воды почками, потери калия в обмен на натрий. В результате развиваются гиперволемическая гипернатриемия и гипокалиемия.
Диагностика гипернатриемии
Для уточнения механизмов гипернатриемии очень важным является исследование осмоляльности мочи и содержания натрия в ней.
Немного физиологии
Осмоляльность мочи, как и общая осмоляльность крови, зависит от концентрации натрия, глюкозы и мочевины. В отличие от величины осмоляльности крови она колеблется в широких пределах: может повышаться (более 400 мОсм/кг воды), быть нормальной (300 – 400 мОсм/кг воды) и пониженной (менее 300 мОсм/кг воды). При отсутствии возможности измерения осмоляльности мочи для приблизительной оценки может быть использована величина удельного веса мочи.
Сочетание высокой осмоляльности мочи и гипернатриемии свидетельствует о возможных трех состояниях:
•дегидратации и пониженном поступлении воды (гиподипсии),
•избытке минералокортикоидов,
•значительном экзогенном введении натрия.
Для дифференциального диагноза этих состояний полезно изучение содержание натрия в моче. Концентрация натрия в моче низкая при дегидратации и других внепочечных причинах гипернатриемии, высокая – при избытке минералокортикоидов и экзогенном введении натрия.
Нормальная осмоляльность мочи и гипернатриемия отмечаются при использовании диуретиков, при нетяжёлом течении несахарного диабета. Низкая осмоляльность мочи и гипернатриемия свидетельствует о тяжелом центральном или нефрогенном несахарном диабете. Содержание натрия в моче во всех этих случаях вариабельное.
Гипонатриемия
Гипонатриемия не является ранним симптомом при ЧМТ. Ее развитие, как правило, отмечается уже в условиях проведения лечения, поэтому при гипонатриемии объем циркулирующей крови почти нормальный или слегка повышен. В отличие от гипернатриемии, которая всегда сопровождается гиперосмоляльным состоянием крови, гипонатриемия может сочетаться как с гиперосмоляльностью, так и с нормо- и гипоосмоляльностью.
Гипертоническая гипонатриемия
Гипертоническая гипонатриемия является наиболее редкой и наименее логичной формой уменьшения содержания натрия в крови. Снижен уровень натрия – основного агента, обеспечивающего осмотические свойства крови, а осмоляльность увеличена! Данный вид гипонатриемии может развиваться только при накоплении в крови значительного количества других осмотически активных веществ – глюкозы, мочевины, крахмала, декстранов, алкоголя, маннитола. Эти агенты могут быть введены извне или вырабатываться эндогенно. Примером эндогенного механизма развития гипертонической гипонатриемии служит гипергликемия из-за декомпенсации сахарного диабета. Такая ситуация нередко встречается у пожилых пациентов с ЧМТ. При повышении осмоляльности крови в ней компенсаторно снижается уровень натрия. Если осмоляльность превышает 295 мОсм/кг воды, включаются механизмы, выводящие натрий из организма. В результате снижается не только концентрация натрия в крови, но и его абсолютное количество.
Гипо- и нормотоническая гипонатриемия
Гипо- и нормотоническая гипонатриемия отражают разную степень активности одних и тех же патологических процессов. В более легких случаях наблюдается нормоосмоляльность. Чаще снижение уровня натрия в крови сопровождается ее гипоосмоляльностью. К гипотонической гипонатриемии при ЧМТ могут приводить пять механизмов:
1.Водная интоксикация.
2.Синдром избыточной выработки АДГ.
3.Ренальный и церебральный сольтеряющие синдромы.
4.Минералокортикоидная недостаточность.
5.Синдром переустановки осмостата (osmostat’s reset).
Первых два механизма вызывают избыток воды, вторые два – недостаток натрия. Последний механизм, скорее всего, отражает так называемую «стресс-норму».
Водная интоксикация
Водная интоксикация развивается чаще ятрогенно, как следствие неадекватной коррекции гиповолемии, сопровождавшейся потерями воды и натрия. К водной интоксикации приводит адекватное восполнение потерь воды и недостаточная коррекция потерь натрия. Одним из аргументов сторонников ограничения применения при ЧМТ растворов глюкозы является развитие водной интоксикации при использовании этих средств. Объяснение следующее: глюкоза метаболизируется до углекислоты и воды. В результате, переливая растворы глюкозы, фактически вводят только воду. Насколько этот механизм важен для развития отека мозга и повышения ВЧД, остается неясным.
Синдром избыточной выработки АДГ
Синдром избыточной выработки АДГ, называемый еще синдромом неадекватной секреции АДГ, приводит к задержке воды в организме за счет ее повышенной реабсорбции в почечных канальцах. В результате снижаются объем мочи и содержание натрия в крови. Несмотря на гипонатриемию, концентрация натрия в моче превышает 30 мэкв/л из-за компенсаторной стимуляции предсердного натрийуретического фактора и подавления секреции альдостерона.
Сольтеряющие синдромы и минералокортикоидная недостаточность
При ренальном и церебральном сольтеряющих синдромах, а также при минералокортикоидной недостаточности отмечаются избыточные потери натрия с мочой. Их непосредственным виновником при церебральном сольтеряющем синдроме является уабаин, который усиливает выведение натрия почками.
Причины развития ренального сольтеряющего синдрома чаще всего остаются неясными. Возможно, значение имеют предшествующие заболевания почек или генетические дефекты с нарушением чувствительности к ПНФ и уабаину. Избыточные потери натрия по сравнению с потерями воды могут наблюдаться при использовании салуретиков. При минералокортикоидной недостаточности низкое содержание альдостерона вызывает нарушение обратного всасывания натрия в почечных канальцах с развитием натрийуреза и гипонатриемии.
Синдром переустановки осмостата («osmostat’s reset»)
При этом синдроме по неясным причинам устанавливается новый нормальный уровень натрия, поэтому почки не реагируют на этот уровень компенсаторными изменениями выделения натрия и воды.
Диагностика гипотонической гипонатриемии
Для дифференциальной диагностики причин гипотонической гипонатриемии в нашей клинике используется следующий алгоритм (рис. 3.2). Согласно этому алгоритму, кроме исследования осмоляльности крови и уровня в ней натрия, обязательным является определение осмоляльности мочи и концентрации в ней натрия. Иногда для детализации диагноза необходимо проведение фармакологических проб. Во всех случаях лечение начинается с введения гипертонических (3%) растворов натрия хлорида.
Высокая осмоляльность мочи (более 400 мОсм/кг воды) в сочетании с гипонатриемией свидетельствует о синдроме избыточной выработки АДГ. Одновременно отмечается повышение концентрации натрия в моче – более 30 мэкв/л. Осмоляльность мочи остается практически постоянной при изменении количества жидкости и темпа ее введения. Это очень важный симптом, так как в остальных случаях гипонатриемии инфузионная нагрузка и ограничение жидкости вызывают соответствующие изменения осмоляльности мочи. Введение 3% раствора хлорида натрия позволяет временно повысить уровень натрия в крови без существенного влияния на содержание натрия в моче.
Гипонатриемия и низкая осмоляльность мочи может сочетаться как с низким, так и с высоким уровнем натрия в моче. Низкий уровень натрия (менее 15 мэкв/л) свидетельствует о водной интоксикации или синдроме переустановки осмостата. Для диагностики водной интоксикации нужно провести тщательный анализ клинической картины, состава вводимых препаратов, исследование функции почек и биохимические анализы крови. Диагноз водной интоксикации ставится на основании исключения всех возможных причин потерь натрия, кроме ограничения натрия в диете и в составе инфузионной терапии. Для дифференциального диагноза между этими синдромами необходимо введение гипертонического раствора хлорида натрия. При водной интоксикации эта фармакологическая проба приводит к восстановлению концентрации натрия в крови с постепенным повышением уровня натрия в моче.
Постепенно нормализуется осмоляльность мочи. Введение гипертонического раствора натрия хлорида при синдроме переустановки осмостата оказывает временный эффект на уровень натрия в крови. В моче после этого теста отмечаются преходящая гипернатриемия и гиперосмоляльность.
Низкая или нормальная осмоляльность мочи с высоким содержанием натрия в моче (более 30 мэкв/л) свидетельствует либо о сольтеряющих синдромах (в том числе из-за использования салуретиков), либо о минералокортикоидной недостаточности. Введение 3% раствора хлорида натрия вызывает временное повышение уровня натрия в крови. Одновременно возрастают потери натрия с мочой. Для дифференциальной диагностики минералокортикоидной недостаточности и сольтеряющих синдромов используют введение препаратов с минералокортикоидными эффектами (например, флудрокортизона).
После применения экзогенных минералокортикоидов при минералокортикоидной недостаточности снижается концентрация натрия в моче и повышается его содержание в крови, при сольтеряющих синдромах эти показатели остаются без изменений.
Нарушения содержания калия
Гипокалиемия
Немного физиологии
Для корректной оценки причин гипокалиемии необходимо использовать правило Гэмбла и понятие анионного провала.
Согласно правилу Гэмбла, организм всегда поддерживает электронейтральность плазмы крови (рис. 3.3). Иными словами, в плазме крови должно быть одинаковое количество противоположно заряженных частиц – анионов и катионов.
Главные катионы плазмы – натрий и калий. Главные анионы – хлор, бикарбонат и белки (в основном альбумин). Кроме них есть множество других катионов и анионов, концентрацию которых трудно контролировать в клинической практике. Плазменная концентрация натрия в норме составляет 140 мэкв/л, калия – 4,5 мэкв/л, кальция – 5 мэкв/л, магния – 1,5 мэкв/л, хлоридов – 100 мэкв/л и бикарбоната – 24 мэкв/л. Примерно 15 мэкв/л обеспечивается за счет отрицательного заряда альбумина (при его нормальном уровне). Разница между содержанием катионов и анионов составляет:
(140 + 4,5 +5+1,5) – (100 + 24 + 15) = 12 (мэкв/л).
Оставшиеся 12 мэкв/л обеспечиваются неопределяемыми анионами и носят название «анионного провала». Неопределяемые анионы представляют собой ионы минеральных кислот, выделяемых почками (сульфат-ион, фосфат-ион и др.). При расчете величины анионного провала обязательно должен учитываться уровень альбумина. При снижении уровня этого белка на каждые 10 г/л создаваемый им заряд уменьшается на 2-2,5 мэкв/л. Соответственно увеличивается анионный провал.
Наиболее частой причиной гипокалиемии является гиповолемия. Снижение объема циркулирующей крови вызывает активацию секреции альдостерона, который обеспечивает компенсаторную задержку натрия. Для того чтобы при задержке в организме натрия сохранялась электронейтральность плазмы крови, почки выводят другой катион – калий (рис. 3.4).
Другой причиной гипокалиемии является ятрогенный избыток минералокортикоидного гормона альдостерона. При ЧМТ эта причина может приводить к гипокалиемии при экзогенном введении гидрокортизона, преднизолона, дексаметазона и других кортикостероидных препаратов, обладающих минералокортикоидными свойствами (рис. 3.5).
Похожие механизмы приводят к гипокалиемии при использовании салуретиков. Фуросемид и другие салуретики вызывают потерю натрия и воды путем блокады реабсорбции этих веществ в почечных канальцах. Потери воды ведут к вторичному гиперальдостеронизму, задержке натрия и выведению калия (рис. 3.6).
Еще одной причиной гипокалиемии при ЧМТ могут быть рвота и постоянная активная аспирация желудочного содержимого по зонду (рис. 3.7). В этих случаях теряется соляная кислота, то есть ионы водорода и хлора, а также вода. Снижение содержания в плазме крови каждого из них может вызывать гипокалиемию путем активации различных механизмов.
•Потери воды индуцируют вторичный альдостеронизм, а почки компенсаторно задерживают натрий и выводят калий.
•Снижение концентрации ионов водорода и хлора в плазме крови вызывает гипохлоремический алкалоз.
Алкалоз – это избыток ионов бикарбоната. Для компенсации такого избытка и поддержания нормального рН плазмы привлекаются ионы водорода, которые поступают из внутриклеточного пространства. Взамен потерянных ионов водорода клетки захватывают калий из плазмы, и он переходит в клетки. В результате развивается гипокалиемия. Метаболический алкалоз и гипокалиемия – очень частое сочетание, независимо от того, что из них является причиной, а что следствием.
Нередкое использование при ЧМТ β-адреномиметиков также приводит к гипокалиемии в результате активации механизмов перераспределение калия из плазмы в клетку (рис. 3.8).
Для уточнения этиологии гипокалиемии информативным является исследование хлоридов в моче. Их высокое содержание (более 10 мэкв/л) характерно для избытка минералокортикоидов (гиперальдостеронизм, гиповолемия). Низкое содержание хлоридов (менее 10 мэкв/л) характерно для других механизмов гипокалиемии.
Немного физиологии
Основной внеклеточный катион – натрий. Основной внутриклеточный катион – калий. Нормальные концентрации ионов в плазме крови: натрия – 135-145 мэкв/л, калия – 3,5-5,5 мэкв/л. Нормальные концентрации ионов внутри клеток: натрия – 13-22 мэкв/л, калия – 78-112 мэкв/л. Поддержание градиента натрия и калия по обе стороны клеточной мембраны обеспечивает жизнедеятельность клетки.
Этот градиент поддерживается работой калий-натриевого насоса. Во время деполяризации клеточной мембраны натрий поступает в клетку, а калий ее покидает согласно градиенту концентраций. Внутри клетки концентрация калия снижается, уровень натрия – повышается. Затем уровень ионов восстанавливается. Калий-натриевый насос «закачивает» калий против градиента концентраций внутрь клетки, а натрий – «выкачивает» из нее (рис. 3.9). В силу того, что в плазме крови уровень калия низкий, незначительные изменения концентрации этого катиона существено сказываются на его абсолютной величине. Повышение уровня калия в плазме с 3,5 до 5,5 мэкв/л, то есть на 2 мэкв/л, означает увеличение более чем на 50%. Повышение концентрации калия внутри клетки с 85 до 87 мэкв/л, то есть на те же 2 мэкв/л, составляет увеличение только на 2,5%! Не стоило бы заниматься этими арифметическими действиями, если бы не постоянная путаница с гипокалиемией и гипокалигистией в учебниках, журнальных публикациях и во время профессиональных дискуссий. Часто можно встретить «научные» рассуждения такого рода: «Мало ли какой уровень калия в плазме, важно – какой он в клетках!». Не говоря о том, что в клинической практике бывает сложно оценить уровень калия внутри клеток, принципиально важно понять, что большинство известных физиологических эффектов калия связаны с его содержвнием в плазме крови и не зависят от концентрации этого катиона в клетках.
Гипокалиемия приводит к следующим негативным последствиям.
•Развивается слабость поперечно-полосатых и гладких мышц. Первыми страдают мышцы ног, затем рук, вплоть до развития тетраплегии. Одновременно отмечаются нарушения функций дыхательной мускулатуры. Даже при умеренной гипокалиемии из-за нарушений функций гладкой мускулатуры появляется парез кишечника.
•Ухудшается чувствительность мышц сосудов к катехоламинам и ангиотензину, в результате чего отмечается нестабильность АД.
•Нарушается чувствительность почечного эпителия к АДГ, следствием чего является развитие полиурии и полидипсии.
•Очень важным негативным последствием гипокалиемии является снижение порога возникновения фибрилляции желудочков и ускорение механизмов циркуляции возбуждающего импульса по проводящей системе сердца - re-entry. Это приводит к увеличению частоты аритмий сердца, запускаемых по этому механизму. На ЭКГ отмечается депрессия сегмента ST, появление зубцов U, сглаживание и инверсия зубцов Т (рис. 3.10). Вопреки распространенному заблуждению, изменения уровня калия существенно не влияют на частоту нормального (синусового) ритма.
Длительное поддержание гиповолемии приводит к истощению не только запасов калия в крови, но и в клетках, то есть гипокалиемия может сопровождаться гипокалигистией. Гипокалигистия имеет менее очевидные негативные последствия, чем гипокалиемия. Эти последствия долго не развиваются из-за больших запасов калия в клетках, но, в конце концов, нарушают метаболические процессы в клетке за счет нарушений работы калий-натриевого насоса.
Указанные патофизиологические механизмы объясняют известное многим реаниматологам чувство «черной дыры», когда ежедневное введение больших доз экзогенного калия позволяет поддерживать уровень калия в плазме крови только на нижней границе нормы. Экзогенно вводимый калий направляется на купирование гипокалигистии и нужно достаточно много времени, чтобы восполнить дефицит калия в организме. Повышение темпа введения экзогенного калия не позволяет разрешить указанную проблему, так как при этом возникает угроза гиперкалиемии при сохраняющейся гипокалигистии.
Гиперкалиемия
Гиперкалиемия при изолированной ЧМТ возникает редко. К её развитию могут приводить два механизма. Первый - ятрогенный. Неэффективные попытки купировать гипокалиемию могут побудить врача чрезмерно увеличить темп введения калий-содержащих растворов. Внутриклеточный сектор может вместить много калия. Но для попадания калия во внутриклеточное пространство нужно определенное время, поэтому клинические эффекты развиваются не из-за изменений уровня калия в клетках, а из-за временного повышения содержания этого иона в плазме крови.
Вторая причина гиперкалиемии при ЧМТ – повреждение почек вследствие травмы, нарушений кровообращения или использования нефротоксических препаратов. В этом случае гиперкалиемия обязательно сочетается с олигурией и является одним из признаков истинной формы острой почечной недостаточности.
Клинические проявления гиперкалиемии в основном связаны с нарушениями сердечного ритма и проводимости. На ЭКГ отмечается расширение комплекса QRS, сужение и рост зубца Т. Интервалы PQ и QT увеличиваются (рис. 3.11). Отмечается мышечная слабость, а также артериальная гипотония из-за периферической вазодилатации и снижения насосной функции сердца.
Другие электролитные нарушения
Нарушения содержания кальция, магния, фосфатов следует предполагать при возникновении необъяснимых нервно-мышечных расстройств. Чаще наблюдается гипомагниемия. В связи с этим при нарушении питания, алкоголизме, воспалительных заболеваниях кишечника и диарее, диабете, использовании ряда лекарственных средств (салуретики, дигиталис, аминогликозиды) необходимо помнить о возмещении возможного дефицита магния.






